FORMULACION Y NOMENCLATURA DE COMPUESTOS ORGANICOS
1. FORMULACION Y NOMENCLATURA DE ALCANOS, ALQUENOS, COMPUESTOS AROMATICOS , HALUROS DE ALQUILO Y DE ARILO, ALCOHOLES, FENOLES, ALDEHIDOS, CETONAS, ACIDOS CARBOXILICOS Y AMINAS.
Alcanos y halogenuros de alquilo
Propiedades físicas
Presentan puntos de fusión y ebullición elevados. Debido a los puentes de hidrógeno,. las moléculas se unen de dos en dos formando dímeros.
Los ácidos carboxílicos presentan una polaridad importante, debida al doble enlace carbono-oxígeno y al grupo hidroxilo, que interacciona mediante puentes de hidrógeno con otras moléculas como agua, alcoholes u otros ácidos carboxílicos. Los ácidos carboxílicos de menor tamaño (hasta cuatro carbonos) son totalmente solubles en agua debido a las importantes interacciones que se establecen entre las moléculas del ácido y las de agua. Puros o en disolución acuosa se encuentran formando dímeros unidos mediante puentes de hidrógeno.
 Acidez y basicidad
Acidez y basicidad
Los ácidos carboxílicos se caracterizan por la importante acidez del hidrógeno situado sobre el grupo hidroxilo. Tambíen se pueden comportar como bases, protonandose sobre el grupo carbonilo.
De un modo similar a los alcoholes los ácidos carboxílicos presentan un comportamiento tanto ácido como básico.
Comportamiento ácido
Comportamiento ácido: el hidrógeno del grupo hidroxilo de los ácidos carboxílicos presenta un pKa comprendido entre 4 y 5, valores relativamente bajos que tienen su explicación en la importante electronegatividad del grupo carbonilo al que está unido y a la estabilización por resonancia de la base conjugada.

Comportamiento básico
Comportamiento básico: la protonación del grupo ácido se produce sobre el oxígeno del grupo carbonilo ya que la especie obtenida se estabiliza por resonancia, deslocalizando la carga positiva sobre el grupo hidroxilo.

Acidez y grupos electronegativos
Los grupos electronegativos aumentan la acidez del los ácidos carboxílicos ya que roban carga por efecto inductivo, estabilizando la base conjugada (ion carboxilato). En la siguiente tabla puede observarse la disminución de pKa que se produce al introducir halógenos en la cadena carbonada, llegándose incluso a valores cercanos a cero.
Métodos de síntesis
Los ácidos carboxílicos se obtienen por hidrólisis de nitrilos, reacción de organometálicos con CO2 y oxidación de alcoholes primarios.
Síntesis de haluros de alcanoilo
Los haluros de ácido se obtienen por reacción de ácidos carboxílicos con tribromuro de fósforo o con oxicloruro de fósforo.
Síntesis de anhídridos a partir de ácidos carboxílicos
La condensación de ácidos carboxílicos o mejor carboxilatos con haluros de alcanoilo produce anhídridos.
Síntesis de ésteres a partir de ácidos.
La reacción de los ácidos carboxílicos con alcoholes en medio ácido los transforma en esteres, una importante reacción conocida como esterificación.
Síntesis da amidas
Las amidas se obtienen por reacción de ácidos y aminas. El proceso se realiza calentando a 150ºC y en ausencia de ácido.
Reacción con reactivos organometálicos
Los organolíticos reaccionan con los ácidos carboxílicos formando cetonas. El hidruro de aluminio y litio los reduce a alcoholes.
Reducción de ácidos carboxílicos
El hidruro de litio y aluminio reduce los ácidos carboxílicos a alcoholes. La reacción transcurre en dos etapas:
- desprotonación del hidrógeno ácido.
- ataque nucleófilo del reductor al carbonilo.
Enolatos de ácido
De modo similar a los aldehídos y cetonas, los ácidos carboxílicos también forman enolatos por pérdida de un hidrógeno α. Los enolatos de ácidos carboxílicos son buenos nucleófilos y dan reacciones de alquilación, apertura de epóxidos, ataque a carbonilos, etc.
11. AMINAS
11.1 Propiedades fisicas. Polaridad, solubilidad, ouentes de H


La reacciones de los aldehídos y cetonas son esencialmente de tres tipos; adición nucleofílica, oxidación y reducción.
1. FORMULACION Y NOMENCLATURA DE ALCANOS, ALQUENOS, COMPUESTOS AROMATICOS , HALUROS DE ALQUILO Y DE ARILO, ALCOHOLES, FENOLES, ALDEHIDOS, CETONAS, ACIDOS CARBOXILICOS Y AMINAS.
Alcanos y halogenuros de alquilo
En el sistema IUPAC, un nombre químico tiene al menos tres partes principales:
prefijo(s), padre y sufijo. El o los prefijos especifican el número, localización, naturaleza y
orientación espacial de los sustituyentes y otros grupos funcionales de la cadena principal. El
padre dice cuantos átomos de carbono hay en la cadena principal y el sufijo identifica al grupo
funcional más importante presente en la molécula.
Prefijo(s) – Padre – Sufijo
Alcanos lineales
Los compuestos orgánicos más sencillos desde un punto de vista estructural son los
alcanos lineales. Estos consisten de cadenas no ramificadas de átomos de carbono, con sus
respectivos hidrógenos, unidos por enlaces simples como se ilustra a continuación. Las
siguientes tres representaciones del pentano son equivalentes.
El nombre general de estos compuestos es alcano; el sufijo es la terminación: ano.
Halogenuros de alquilo
En la nomenclatura común de estos compuestos, sus nombres son similares a los de sales
inorgánicas. Esta nomenclatura aún se usa ampliamente.
Aunque desde un punto de vista químico los halogenuros de alquilo son muy diferentes a
los alcanos, para propósitos de nomenclatura IUPAC estos son prácticamente iguales. Cada
átomo de halógeno se nombra con los prefijos fluoro, cloro, bromo y yodo y se trata como si fuera
otro sustituyente alquilo.
ALQUENOS
La cadena principal es la cadena más larga que contenga a los dos carbonos del doble
enlace. La terminación ano del alcano correspondiente se cambia a eno para indicar la presencia
del doble enlace.
Alquinos
Los alquinos siguen las mismas reglas generales de nomenclatura de hidrocarburos ya
discutidas. Para denotar un alquino, el sufijo ano es sustituido por ino en el nombre del
compuesto. La posición del triple enlace se indica con su número en la cadena. La numeración
empieza por el extremo de la cadena más cercano al triple enlace.
Compuestos aromáticos
Derivados monosustituidos del benceno se nombran de la misma forma que otros
hidrocarburos pero usando benceno como nombre padre. Bencenos sustituidos por grupos
alquilo se nombran de dos formas diferentes dependiendo del tamaño del grupo alquilo. Si el
sustituyente es pequeño (seis átomos de carbono o menos) el compuesto se nombra como un
benceno sustituido por el grupo alquilo, por ejemplo, etilbenceno. Si el sustituyente tiene más de
6 carbonos, el compuesto se nombra como un alquilo sustituido por el benceno, por ejemplo, 2-
fenildecano. Cuando el benceno se considera un sustituyente, se utiliza el nombre fenil en el
nombre del compuesto.
Compuestos monofuncionales
Todos los compuestos que contienen un solo grupo funcional se nombran siguiendo el
procedimiento descrito para alcanos. Sólo que ahora la cadena principal debe contener al grupo
funcional y este determina el sufijo del compuesto.
Alcoholes
La cadena principal del compuesto debe contener al carbono enlazado al grupo OH y ese
carbono debe recibir el índice más bajo posible. La terminación o del alcano correspondiente a la
cadena principal se sustituye por ol para indicar que se trata de un alcohol. De forma análoga a
los alquenos, se antepone un prefijo al nombre padre para especificar la posición del grupo
funcional, en este caso el OH.
Eteres
Existen dos maneras de dar nombre a estos compuestos. Los éteres simples se nombran
mencionando los grupos orgánicos que los constituyen y anteponiendo la palabra éter.
Aldehídos
Los nombres de los aldehídos se derivan del nombre del alcano con el mismo número de
átomos de carbono. La o final del alcano se reemplaza con el sufijo al. Ya que este grupo
funcional está siempre al final de una cadena, no es necesario especificar su posición en el
nombre, pero su presencia sí determina la numeración de la cadena. Aldehídos más complejos en
donde el grupo –CHO está enlazado a un anillo utilizan el sufijo carbaldehído en lugar de al.
Cetonas
Se reemplaza la terminación o de la cadena principal con ona, se numera la cadena de tal
forma que se asigne al carbonilo el índice más bajo posible y se indica esta posición en el nombre
del compuesto.
Acidos carboxílicos
El nombre de estos compuestos se forma anteponiendo la palabra ácido y cambiando la o
final del alcano correspondiente por oico. El carbono carboxílico siempre lleva el índice 1.
Esteres
Los ésteres reciben nombres como si fueran sales inorgánicas. La terminación ico del
ácido correspondiente se cambia a ato y luego se menciona el grupo alcohoxilo con la
terminación ilo separando las dos palabras con la palabra de.
Amidas
Las amidas se nombran a partir del ácido que les da origen, eliminando la palabra ácido
y cambiando la terminación oico o ico por amida o la
terminación carboxílico por carboxamida.
Si la amida tiene sustituyentes alquílicos en el átomo de nitrógeno, se indica su posición con el
prefijo N-.
Aminas
Aminas primarias simples se nombran agregando el sufijo amina al nombre del
sustituyente alquílico (metil, etil, etc.).
2. EL ENLACE QUIMICO EN LOS COMPUESTOS DE CARBONO
2.1 ENLAC COVALENTE, ENLACE IONICO, Y ENLACE COORDINADO EN COMPUESTOS DE CARBONO.
2.2 POLARIDAD EN ENLACE COVALENTE Y SU EFECTO SOBRE LAS PROPIEDADES FISICAS; PUNTO DE FUSION, PUNTO DE EBULLICION Y SOLUBILIDAD.
2.3 POLARIDAD DEL ENLACE COVALENTE Y SU EFECTO SOBRE LAS PROPIEDADES QUIMICAS: HOMOLISIS Y HETEREOLISIS, HOMOLISIS: formacion de radicales libres, su estructura reacctividad y factores que cataliza la hosmeolisis, HETEREOLISIS: formacion de iones, produccion de carbocationes y carbaiones, como consecuencia de la heterolisis en los compuestos organicos. Los acidos y las bases como ejempko de compuestis de comportamiento hetereolico.
Los cuatro enlaces del carbono se orientan simétricamente en el espacio de modo que considerando su núcleo situado en el centro de un tetraedro, los enlaces están dirigidos a lo largo de las líneas que unen dicho punto con cada uno de sus vértices. La formación de enlaces covalentes puede explicarse, recurriendo al modelo atómico de la mecánica cuántica, como debida a la superposición de orbitales o nubes electrónicas correspondientes a dos átomos iguales o diferentes. Así, en la molécula de metano CH4(combustible gaseoso que constituye el principal componente del gas natural), los dos electrones internos del átomo de C, en su movimiento en torno al núcleo, dan lugar a una nube esférica que no participa en los fenómenos de enlace; es una nube pasiva . Sin embargo, los cuatro electrones externos de dicho átomo se mueven en el espacio formando una nube activa de cuatro lóbulos principales dirigidos hacia los vértices de un tetraedro y que pueden participar en la formación del enlace químico. Cuando las nubes electrónicas de los cuatro átomos de hidrógeno se acercan suficientemente al átomo de carbono, se superponen o solapan con los lóbulos componentes de su nube activa, dando lugar a esa situación favorable energéticamente que denominamos enlace.
Todos los enlaces C —H en el metano tienen la misma longitud 1,06 Å (1 Å == 10-10 m) y forman entre, sí ángulos iguales de 109°. Tal situación define la geometría tetraédrica característica de los enlaces del carbono. La propiedad que presentan los átomos de carbono de unirse de forma muy estable no sólo con otros átomos,sino también entre sí a través de enlaces C — C, abre una enorme cantidad de posibilidades en la formación de moléculas de las más diversas geometrías, en forma de cadenas lineales,cadenas cíclicas o incluso redes cúbicas. Este es el secreto tanto de la diversidad de compuestos orgánicos como de su elevado número.
Ruptura homolítica u homolisis
Es propia de dos átomos que no tienen una gran diferencia en electronegatividad. Cada átomo "se lleva" un electrón de cada pareja de electrones de enlace: da lugar a radicales libres. Así se mide la Energía de Disociación.
Ruptura heterolítica o heterolisis
Es propia de dos átomos cuya electronegatividad es diferente. El átomo electronegativo "se lleva" los dos electrones de enlace: da lugar a iones. En general este proceso es menos costoso energéticamente que la ruptura homolítica.
Es propia de dos átomos que no tienen una gran diferencia en electronegatividad. Cada átomo "se lleva" un electrón de cada pareja de electrones de enlace: da lugar a radicales libres. Así se mide la Energía de Disociación.
Ruptura heterolítica o heterolisis
Es propia de dos átomos cuya electronegatividad es diferente. El átomo electronegativo "se lleva" los dos electrones de enlace: da lugar a iones. En general este proceso es menos costoso energéticamente que la ruptura homolítica.
3. ALCANOS
3.1 EL METANO COMO ALCANO TIPICO, SU ESTRUCTURA, TIPO DE ENLACES. LA HIBRIDACION SP3.
3.2 CARACTERISTICA DEL CARBONO EN LOS ALCANOS Y SIMETRIA. ORBITALES Y SUS PROPIEDADES ESTRUCTURALES.
3.3 RELACION ENTRE LA ESTRUCTURA QUIMICA Y LAS PROPIEDADES FISICAS DE LOS ALCANOS. ISOMERIA. RELACION ENTRE LA ISOMERIA Y LAS PROPIEDADES DISICAS; CAMBIOS CONFORMACIONALES. DESHIDROGENACION. COMBUSTION. IMPORTANCIA DE LA CONCENTRACION DEL OXIDANTE
3.5 CICLOALCANOS
Los alcanos son hidrocarburos (formados por carbono e hidrógeno) que solo contienen enlaces simples carbono-carbono. Se clasifican en lineales, ramificados, cíclicos y policíclicos.
Los puntos de fusión y ebullición de alcanos son bajos y aumentan a medida que crece el número de carbonos debido a interacciones entre moléculas por fuerzas de London. Los alcanos lineales tienen puntos de ebullición más elevados que sus isómeros ramificados.
Los alcanos no son rígidos debido al giro alrededor del enlace C-C. Se llaman conformaciones a las múltiples formas creadas por estas rotaciones.
Dada su escasa reactividad los alcanos también se denominan parafinas. Las reacciones más importantes de este grupo de compuestos son las halogenaciones radicalarias y la combustión. La combustión es la combinación del hidrocarburo con oxígeno, para formar dióxido de carbono y agua
Los cicloalcanos son alcanos que tienen los extremos de la cadena unidos, formando un ciclo. Tienen dos hidrógenos menos que el alcano del que derivan, por ello su fórmula molecular es CnH2n. Se nombran utilizando el prefijo ciclo seguido del nombre del alcano.
4. ALQUENOS
4.1 ESTRUCTURA. LA HIBRIDACION SP2 DEL CARBONO. FORMACION DEL ENLACE PI
4.2 ISOMERIA CIS-TRANS. ROPIEDADES DEL ENLACE PI. EFECTO DE LA POLARIDAD MOLECULAR.
4.3 REACCIONES CARACTERISTICAS: ADICION ELECTROFILICA, ADICION POR RADICALES LIBRES, HIDROGENACION, POLIMERIZACION DE ALQUENOS, SEMEJANZAS CON POLIMEROS BIOLOGICOS.
4.4 PREPARACION DE ALQUENOS: DESHIDRATACION DE ALCOHOLES.A PARTIR DE COMPUESTOS HALOGENADOS.
Los alquenos son hidrocarburos insaturados que contienen uno o más dobles enlaces C = C. El nombre de los hidrocarburos insaturados se debe a que los carbonos que sostienen el doble enlace todavía pueden enlazarse a hidrógenos.
• CLASIFICACION DE LOS ALQUENOS
• Alquenos simples: presentan un solo doble enlace
• C = C.
• Alcadienos :
• Vecinos o acumulados: presentan dos dobles enlaces sostenidos del mismo carbono,
• C H 2 = C = CH - CH 3 .
• Extremos: presentan dos dobles enlaces, uno en cada extremo de la molécula,
• CH 2 = CH - CH 2 - CH = CH 2 .
• Conjugados : presentan dos dobles enlaces, alternados;
• CH 2 = CH -CH = CH - CH 3 .
• Alcapolienos: presentan más de dos dobles enlaces: CH 2 =C=C = CH - CH 3
NOMENCLATURA:
• Localizar la cadena continua de carbonos más larga y que contenga la mayor cantidad posible de dobles enlaces. Nombrar esta cadena con las mismas raíces utilizadas para los alcanos; pero dándoles la terminación característica de los alquenos ( eno, dieno, trieno ), según sea el número de dobles enlaces presentes en la molécula , e indicando la posición de cada uno de ellos.
• Numerar los carbonos de la cadena anterior, de tal manera que los dobles enlaces queden en la menor posición posible. Si éstos equidistan de ambos extremos, numerar la cadena de tal manera que las ramificaciones queden en la menor posición posible.
• Nombrar cada una de las ramificaciones de igual manera que en los alcanos.
• Terminar el nombre del alqueno escribiendo el nombre de la cadena principal o base de la molécula.
• Cuando una ramificación presente dobles enlaces, se nombrará utilizando las mismas raíces que para los grupos alquil; pero con la teminación característica de los grupos alqueniles (enil, dienil, trienil) según sea el número de dobles enlaces presentes en la ramificación, e indicando cada una de sus posiciones.
• NOTA: Cuando se presenta el doble enlace es común encontrar isómeros cis-trans. Estos se nombrarán anteponiendo el prefijo cis o trans a todo el nombre del alqueno, según sea el caso.
PROPIEDADES FISICAS DE LOS ALQUENOS
• Solubilidad: Los alquenos son compuestos no polares, por lo tanto se disuelven en solventes no polares como el benceno, otro hidrocarburo, éter.
• Puntos de ebullición: son ligeramente inferiores a los de los alcanos correspondientes.
6.ALCOHOLES
6.1 PROPIEDADES FISICAS. POLARIDAD, SOLUBILIDAD, ANFIPATIA, PUENTES H.
6.2 CLASIFICACION DE ALCOHOLES
6.3 ETANOL Y METANOL COMO ALCOHOLES TIPICOS
6.4 RELACIONES FUNDAMENTALES: DESHIDRATACION, FORMACION DE ALQUENOS, FORMACION DE ETERES, ETERES CICLICOS, REACCIONES CON METALES, LOS ALCOHOLES COMO ACIDOS, FORMACION DE ETERES, LOS ALCOHOLES COMO BASES, OXIDACION
6.5 DIFERENCIA ENTRE ALCOHOLES Y FENOLES
6.6 POLIOLES
6.7 ENOLES
Los enoles son compuestos en lo que uno de los átomos de hidrógeno unido a un carbono de un doble enlace es remplazado por un grupo hidroxilo. Los enoles están relacionados con los compuestos carbonílicos por un equilibrio de transferencia protónica conocida como tautomería ceto-enólica:
Los enoles son compuestos en lo que uno de los átomos de hidrógeno unido a un carbono de un doble enlace es remplazado por un grupo hidroxilo. Los enoles están relacionados con los compuestos carbonílicos por un equilibrio de transferencia protónica conocida como tautomería ceto-enólica:
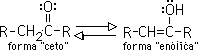
Esta tautomería ceto-enólica es característica de todos los compuestos carbonílicos que contengan hidrógenos alfa (hidrógenos en un carbono adyacente al carbonilo). La forma ceto y la forma enólica no son sino isómeros en equilibrio; el sistema se genera por la migración reversible del hidrógeno alfa al oxígeno del grupo carbonilo:
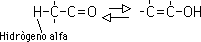
Sólo una pequeña cantidad del enol está presente en un aldehído o una cetona simple, por lo que la forma "ceto" prevalece sobre la forma "enólica". Sin embargo, hay casos en que el equilibrio favorece a la forma enólica. Por ejemplo, en 2,4 pentadiona el isómero enólico compara en estabilidad con la forma ceto y podría predominar en el equilibrio:
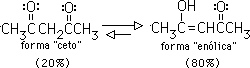
Cuando se remueve el protón del enol o del compuesto carbonílico en equilibrio con éste,se produce un anión deslocalizado conocido como ion enolato:

La formación del enolato de 2,4-pentadiona se favorece porque la carga negativa puede deslocalizarse entre los dos carbonilos:

Los enolatos son las bases conjugadas de compuestos carbonílicos con hidrógenos alfa. Por lo general, el pKa de estos compuestos fluctúa entre 10 y 25, lo que implica que los enolatos son nucleofilos, muchos de ellos fuertes.
Las reacciones que involucran iones enolatos de compuestos carbonílicos son mayormente de adición, condensación o reemplazo. A continuación se ofrece un resumen de algunas de estas reacciones:
1- Halogenación alfa en aldehídos y cetonas:
Puede ser con Cl2, Br2,o I2, y está catalizada por ácido o promovida por base. En ácido, la reacción se limita a una monohalogenación por cada hidrógeno alfa. En medio básico , y en exceso de halógeno, se substituyen todos los posibles hidrógenos alfa.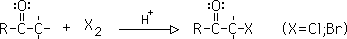
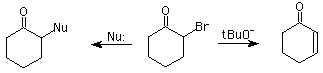
2- Reacción del haloformo:
En exceso de halógeno, una metilcetona se convierte primero en una sal de ácido carboxílico, liberando un haloformo. Si el halógeno es yodo, se precipita yodoformo, CHI3, un sólido amarillo.
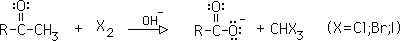
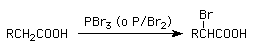
Con diisopropilamida de litio (DAL) todos los compuestos carbonílicos se convierten en iones enolato casi en un 100%. Luego de esa conversión el ión enolato se puede usar para reacción con un electrofilo. Si el lectrofilo es un halogenuro de alquilo, se puede llevar a cabo una SN2, generándose una alquilación en posición alfa.

En ciertas instancias, puede haber mezcla de productos, reacciones que pueden estar bajo control cinético o termodinámico:

Aldehídos y cetonas reaccionan con aminas secundarias para producir enamimas.
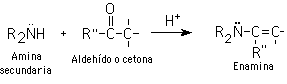

6-Adición de Michael (adición conjugada)
Es la adición de un ion enolato (nucleofilo) a un compuesto carbonílico alfa, beta insaturado. Los mejores enolatos para esta reacción son aquellos que están flanqueados por dos grupos que atraigan electrones: enolatos de ß-dicetonas, ß-diésteres, ß-cetoésteres y ß-ceto nitrilos.
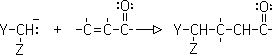
Si en lugar de enolatos se usan enaminas, la reacción se conoce como Stork-enamina
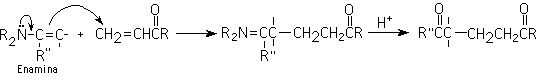
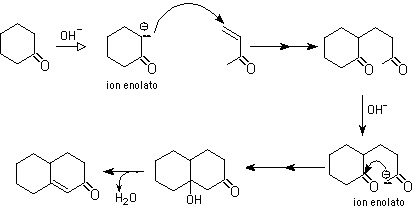
7- Condensación aldólica:
Es la reacción entre dos aldehídos o dos cetonas. Una molécula genera el enolato y ataca la segunda molécula por una adición nucleofílica. El resultado es un ß-hidroxialdehído (aldol= aldehído alcohol)) o una ß-hidroxicetona

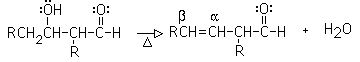
Condensación aldólica cruzada: se produce cuando uno de los dos compuestos carbonílicos carece de hidrógenos alfa. Este es el que sufre la adición del enolato, generado por el otro compuesto carbonílico, que sí tiene hidrógenos alfa. Ambos compuestos carbonílicos pueden ser aldehídos, o cetonas on una mezcla.
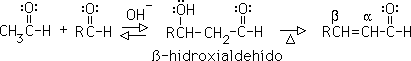
Reacción entre dos ésteres en la que el producto es un ß-cetoéster.

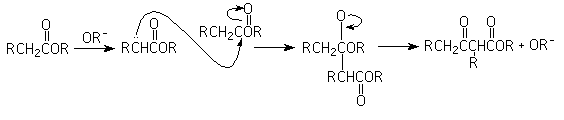
8- Condensación de Dieckmann:
Es una condensación de Claisen intramolecular, pra producir un ß-cetoéster cíclico de 5 o 6 miembros en el anillo:
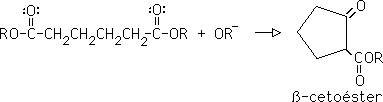
Una vez alquilado, el producto se hidroliza en medio ácido, lo que genera un ß-diacido, que se descarboxila, generando un ácido carboxílico:
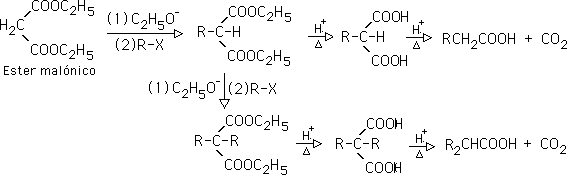
10-Síntesis acetoacética: es la formación de cetonas partiendo del éster acetoacetíico. La reacción puede ser una monoalquilación o una dialquilación en el carbono alfa del éster, via una SN2.Una vez alquilado, el producto se hidroliza en medio ácido, lo que genera un ß-cetoéster, que se descarboxila, generando una cetona:
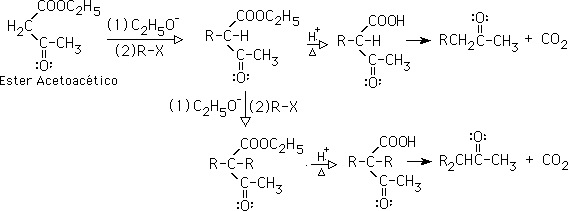
Es una reacción que combina dos procesos de formación de nuevos enlaces carbono-carbono: reacción de Michael y la adición aldólica. El resultado final es la formaci&oacutre;n de una ciclohexanona.

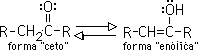
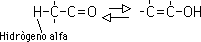
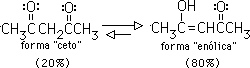


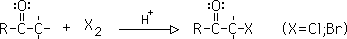

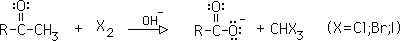
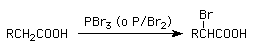


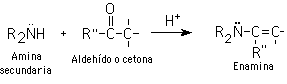

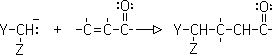
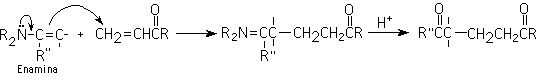

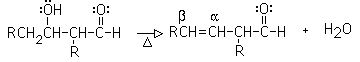
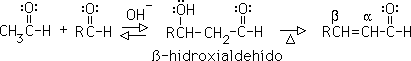


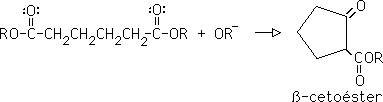
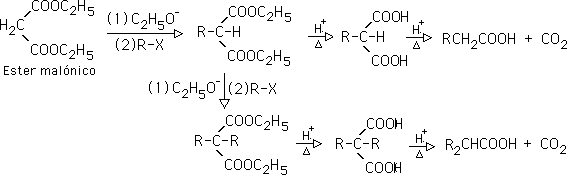
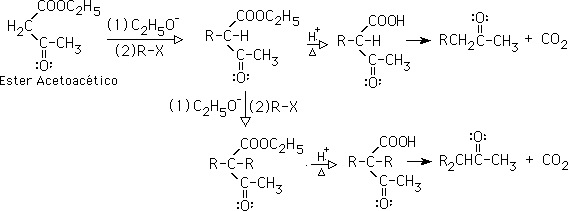


Nomenclatura de alcoholes
7. ALDEHIDOS Y CETONAS
7.1 ESTRUCTURA, RESONANCIA DEL GRUPO CARBONILO
7.2 PROPIEDADES FISICAS. POLARIDAD, SOLUBILIDAD, ANTIPATIA.
7.3 PROPIEDADES QUIMICAS. EQUILIBRIO CETO-ENOLICO. ADICION NUCLEOFILICA. EJEMPLOS: REACCION CON DERIVADAS DEL AMONIACO. REACCION CON ALCOHOLES: FORMACION DE HEMIACETALES Y ACETALES, ESTRUCTURA CICLICA CON CARBOHIDRATOS, ACIDEZ DE LOS ALDEHIDOS, OXIDACION.
Aldehídos y cetonas se caracterizan por tener el grupo carbonilo 

La fórmula general de los aldehídos es 

La fórmula general de las cetonas es 

10. ACIDOS CARBOXILICOS
10.1 acidez en funcion de la resonancia
10.2 Propiedades fisicas. Polaridad, solubilidad, anfilpatia, puentes de H
10.3 Propiedades quimicas. Reacciones acido base, formacion de sales, esterificacion, saponificacion.
| Propiedades físicas de los Ácidos Carboxílicos |  |  |
| Los ácidos carboxílicos son moléculas con geometría trigonal plana. Presentan hidrógeno ácido en el grupo hidroxilo y se comportan como bases sobre el oxígeno carbonílico.
Los puntos de fusión y ebullición son elevados ya que forman dímeros, debido a los enlaces por puentes de hidrógeno.
|
Propiedades físicas
Presentan puntos de fusión y ebullición elevados. Debido a los puentes de hidrógeno,. las moléculas se unen de dos en dos formando dímeros.
Los ácidos carboxílicos presentan una polaridad importante, debida al doble enlace carbono-oxígeno y al grupo hidroxilo, que interacciona mediante puentes de hidrógeno con otras moléculas como agua, alcoholes u otros ácidos carboxílicos. Los ácidos carboxílicos de menor tamaño (hasta cuatro carbonos) son totalmente solubles en agua debido a las importantes interacciones que se establecen entre las moléculas del ácido y las de agua. Puros o en disolución acuosa se encuentran formando dímeros unidos mediante puentes de hidrógeno.
 Acidez y basicidad
Acidez y basicidadLos ácidos carboxílicos se caracterizan por la importante acidez del hidrógeno situado sobre el grupo hidroxilo. Tambíen se pueden comportar como bases, protonandose sobre el grupo carbonilo.
De un modo similar a los alcoholes los ácidos carboxílicos presentan un comportamiento tanto ácido como básico.
Comportamiento ácido
Comportamiento ácido: el hidrógeno del grupo hidroxilo de los ácidos carboxílicos presenta un pKa comprendido entre 4 y 5, valores relativamente bajos que tienen su explicación en la importante electronegatividad del grupo carbonilo al que está unido y a la estabilización por resonancia de la base conjugada.

Comportamiento básico
Comportamiento básico: la protonación del grupo ácido se produce sobre el oxígeno del grupo carbonilo ya que la especie obtenida se estabiliza por resonancia, deslocalizando la carga positiva sobre el grupo hidroxilo.

Acidez y grupos electronegativos
Los grupos electronegativos aumentan la acidez del los ácidos carboxílicos ya que roban carga por efecto inductivo, estabilizando la base conjugada (ion carboxilato). En la siguiente tabla puede observarse la disminución de pKa que se produce al introducir halógenos en la cadena carbonada, llegándose incluso a valores cercanos a cero.
Métodos de síntesis
Los ácidos carboxílicos se obtienen por hidrólisis de nitrilos, reacción de organometálicos con CO2 y oxidación de alcoholes primarios.
Síntesis de haluros de alcanoilo
Los haluros de ácido se obtienen por reacción de ácidos carboxílicos con tribromuro de fósforo o con oxicloruro de fósforo.
Síntesis de anhídridos a partir de ácidos carboxílicos
La condensación de ácidos carboxílicos o mejor carboxilatos con haluros de alcanoilo produce anhídridos.
Síntesis de ésteres a partir de ácidos.
La reacción de los ácidos carboxílicos con alcoholes en medio ácido los transforma en esteres, una importante reacción conocida como esterificación.
Síntesis da amidas
Las amidas se obtienen por reacción de ácidos y aminas. El proceso se realiza calentando a 150ºC y en ausencia de ácido.
Reacción con reactivos organometálicos
Los organolíticos reaccionan con los ácidos carboxílicos formando cetonas. El hidruro de aluminio y litio los reduce a alcoholes.
Reducción de ácidos carboxílicos
El hidruro de litio y aluminio reduce los ácidos carboxílicos a alcoholes. La reacción transcurre en dos etapas:
- desprotonación del hidrógeno ácido.
- ataque nucleófilo del reductor al carbonilo.
Enolatos de ácido
De modo similar a los aldehídos y cetonas, los ácidos carboxílicos también forman enolatos por pérdida de un hidrógeno α. Los enolatos de ácidos carboxílicos son buenos nucleófilos y dan reacciones de alquilación, apertura de epóxidos, ataque a carbonilos, etc.
11. AMINAS
11.1 Propiedades fisicas. Polaridad, solubilidad, ouentes de H
Aldehídos
El sistema de nomenclatura corriente consiste en emplear el nombre del alcano correspondiente terminado en -al.
Cuando el grupo CHO es sustituyente se utiliza el prefijo formil-.
También se utiliza el prefijo formil- cuando hay tres o más funciones aldehídos sobre el mismo compuesto .En esos casos se puede utilizar otro sistema de nomenclatura que consiste en dar el nombre decarbaldehído a los grupos CHO (los carbonos de esos CHO no se numeran, se considera que no forman parte de la cadena).Este último sistema es el idóneo para compuestos con grupos CHO unidos directamente a ciclos.

Cetonas
Para nombrar los cetonas tenemos dos alternativas:
- El nombre del hidrocarburo del que procede terminado en -ona .Como sustituyente debe emplearse el prefijo oxo-.
- Citar los dos radicales que están unidos al grupo carbonilo por orden alfabético y a continuación la palabra cetona.

| Propiedades físicas |
Los compuestos carbonílicos presentan puntos de ebullición más bajos que los alcoholes de su mismo peso molecular.No hay grandes diferencias entre los puntos de ebullición de aldehídos y cetonas de igual peso molecular.
Los compuestos carbonílicos de cadena corta son solubles en agua y a medida que aumenta la longitud de la cadena disminuye la solubilidad.
| Síntesis |
- Ozonólisis de alquenos
- Tratamiento con KMnO4 en caliente de alquenos.Este método sólo es válido para la preparación de cetonas.
- Hidratación de alquinos
- Hidroboración-oxidación de alquinos
- Acilación de Friedel-Crafts del Benceno
- Oxidación de alcoholes
| Reacciones |
La reacciones de los aldehídos y cetonas son esencialmente de tres tipos; adición nucleofílica, oxidación y reducción.
- Adición nucleofílica Debido a la resonancia del grupo carbonilo
 la reacción más importante de aldehídos y cetonas es la reacción de adición nucleofílica cuyo mecanismo es el siguiente:
la reacción más importante de aldehídos y cetonas es la reacción de adición nucleofílica cuyo mecanismo es el siguiente: Siguen este esquema la reacción con hidruros ( NaBH4, LiAlH4 ) donde Nu- = H- y la reacción con organometálicos (RMgLi, RLi) donde Nu- = R-.Adición nucleofílica de alcoholes
Siguen este esquema la reacción con hidruros ( NaBH4, LiAlH4 ) donde Nu- = H- y la reacción con organometálicos (RMgLi, RLi) donde Nu- = R-.Adición nucleofílica de alcoholes
 Adición de amina primaria
Adición de amina primaria Adición de Hidroxilamina
Adición de Hidroxilamina Adición de hidracinas
Adición de hidracinas Adición de Ácido Cianhídrico
Adición de Ácido Cianhídrico
- Oxidación

- Reducción Hidruro
 Hidrogenación
Hidrogenación Reducción de Clemmensen
Reducción de Clemmensen Reacción de Wolff-Kishner
Reacción de Wolff-Kishner
| Aldehídos | ||
El primer grupo de compuestos carbonilados que vamos a ver son los aldehídos. Se forman cuando sólo uno de los dos enlaces del carbono del grupo carbonilo está unido a una cadena hidrocarbonada, estando el otro unido a un átomo de hidrógeno, y se nombran sustiituyendo la terminación -o de los alcanos por la terminación -al. El más simple de ellos es el aldehído derivado del metano, el metanal, conocido comunmente como formol, y que se usa para conservar muestras en biología y medicina.
|
Se nombran sustituyendo la terminación de los alcanos -ano por -ol. Se toma como cadena principal la más larga que contenga el grupo hidroxilo y se numera otorgándole el localizador más bajo.
Acidez y basicidad de los alcoholes
Los alcoholes son ácidos, el hidrógeno del grupo -OH tiene un pKa de 16.
Propiedades físicas
Los puntos de fusión y ebullición son elevados debido a la formación de puentes de hidrógeno.
Síntesis de alcoholes
Se obtienen mediante sustitución nucleófila y por reducción de aldehídos y cetonas. El ataque de reactivos organometálicos a electrófilos -carbonilos, epoxidos, esteres- es un método importante en la síntesis de alcoholes.
Obtención de haloalcanos a partir de alcoholes
Los alcoholes se transforman en haloalcanos por reacción con PBr3. El mecanismo es del tipo SN2 y requiere alcoholes primarios o secundarios.
Oxidación de alcoholes
El trióxido de cromo oxida alcoholes primarios a ácidos carboxílicos y alcoholes secundarios a cetonas. También se pueden emplear otros oxidantes como el permanganato de potasio o el dicromato de potasio.
Formación de alcóxidos
Las bases fuertes los desprotonan formando los alcóxidos.
Solubilidad:
Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2-propanol.
A partir de 4 carbonos en la cadena de un alcohol, su solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en comparación con la porción hidrocarburo. A partir del hexanol son solubles solamente en solventes orgánicos.
Existen alcoholes de cuatro átomos de carbono que son solubles en agua, debido a la disposición espacial de la molécula. Se trata de moléculas simétricas.
Existen alcoholes con múltiples moléculas de OH (polihidroxilados) que poseen mayor superficie para formar puentes de hidrógeno, lo que permiten que sean bastante solubles en agua.
Punto de Ebullición: Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones.
El punto de fusión aumenta a medida que aumenta la cantidad de carbonos.
Densidad: La densidad de los alcoholes aumenta con el número de carbonos y sus ramificaciones. Es así que los alcoholes alifáticos son menos densos que el agua mientras que los alcoholes aromáticos y los alcoholes con múltiples moléculas de –OH, denominados polioles, son más densos
Propiedades Químicas:
Los alcoholes pueden comportarse como ácidos o bases, esto gracias al efecto inductivo, que no es más que el efecto que ejerce la molécula de –OH como sustituyente sobre los carbonos adyacentes. Gracias a este efecto se establece un dipolo.
La estructura del alcohol está relacionada con su acidez. Los alcoholes, según su estructura pueden clasificarse como metanol, el cual presenta un sólo carbono, alcoholes primarios, secundarios y terciarios que presentan dos o más moléculas de carbono.
Debido a que en el metanol y en los alcoholes primarios el hidrógeno está menos firmemente unido al oxígeno, la salida de los protones de la molécula es más fácil por lo que la acidez será mayor en el metanol y el alcohol primario.
Deshidratación: la deshidratación de los alcoholes se considera una reacción de eliminación, donde el alcohol pierde su grupo –OH para dar origen a un alqueno. Aquí se pone de manifiesto el carácter básico de los alcoholes. La reacción ocurre en presencia de ácido sulfúrico (H2SO4) en presencia de calor.
El calentamiento de un alcohol en presencia de ácido sulfúrico a temperaturas inferiores a las necesarias para obtener alquenos producirá otros compuestos como éteres y ésteres.
Obtención de alcoholes: al igual que a partir de los alcoholes se pueden obtener otros compuestos, los alcoholes pueden ser obtenidos a partir de hidratación o hidroboración – oxidación de alquenos, o mediante hidrólisis de halogenuros de alquilo. Para la obtención de alcoholes por hidratación de alquenos se utiliza el ácido sulfúrico y el calor.
La hidroboración: (adición de borano R3B) de alqueno en presencia de peróxido de hidrógeno (H2O2) en medio alcalino da origen a un alcohol.
La hidrólisis: de halogenuros de alquilo o aralquilo se produce en presencia de agua y hidróxidos fuertes que reaccionan para formar alcoholes.
En la industria la producción de alcoholes se realiza a través de diversas reacciones como las ya mencionadas, sin embargo se busca que éstas sean rentables para proporcionar la máxima cantidad de producto al menor costo. Entre las técnicas utilizadas por la industria para la producción de alcoholes se encuentra la fermentación donde la producción de ácido butírico a partir de compuestos azucarados por acción de bacterias como el Clostridium butycum dan origen al butanol e isopropanol. Para la producción de alcoholes superiores en la industria la fermentación permite la producción de alcoholes isoamílico, isobutílico y n-propílico a partir de aminoácidos. Es así como la industria utiliza los procesos metabólicos de ciertas bacterias para producir alcoholes.
AMINAS
AMINAS
11.1 Propiedades fisicas. Polaridad, solubilidad, puentes H.
11.2 Clasificacion de aminas
11.2 Clasificacion de aminas
11.3 Reacciones. Reacciones acido-base, Formacion de sales, Conversion a amidas
11.4 Importancia de las aminas en los sistemas biologicos: Bases puricas y pirimidicas. Enlace peptidico como base de la estructura proteica
Las aminas se derivan del amoníaco por sustitución de los átomos de hidrógeno por
radicales alquilos (aminas alifáticas) y arilos (aminas aromáticas). Se pueden obtener tres tipos de aminas, denominadas aminas primarias, secundarias y terciarias que se distinguenpor el número de grupos sustituyentes unidos al nitrógeno. Además, existe una cuarta clasede compuestos relacionados que son las sales de amonio cuaternarias, las cuales se obtienen por sustitución de los cuatro átomos de hidrógeno del catión amonio por radicales alquilos o arilos
Sal de amonio
A las aminas se les da el nombre especificando el (los) nombre (s) del (los) grupos
alquílicos y añadiendo el sufijo “amina”. Cuando en la misma hay varios sustitusyentes
idénticos, se emplean los prefijos di, tri, tetra, etc. Cuando los grupos son distintos, se
mencionan en orden de complejidad.
Las aminas alifáticas Metilamina, CH3–NH2, y Etilamina, CH3–CO– NH2, son aminas
primarias. La dimetilamina, (CH3)2-NH, y la Metiletilamina, CH3-NH-CH2-CH3, son
aminas secundarias. La trimetilamina, (CH3)3N, es una amina terciaria.
La fenilamina o anilina, C6H5-NH2, es la amina aromática mas importante, y ciertos
compuestos suelen nombrarse como derivados de la misma. Para indicar que un
sustituyente se encuentra unido al nitrógeno, se escribe una N mayúscula antes de aquel, como por ejemplo, la N,N-dimetilanilina o dimetilfenilamina, C6H5-N(CH3)2. Un ejemplo de sal de amonio cuaternario es el cloruro de tetrametil amonio, (CH3)4NCl
PROPIEDADES FISICAS DE LAS AMINAS
Los miembros inferiores de la serie se asemejan al amoníaco, son gases incoloros, solubles en agua, de olores penetrantes pero menos picantes y mas con olor a pescado. El olor a pescado se atribuye a la presencia de aminas en líquidos corporales del pescado (dimetilamina y trimetilamina). Algunos de los productos de la descomposición de la carne humana en putrefacción son diaminoalcanos. Poseen olores muy desagradables y sus nombres se deben a su olor y a su procedencia. Por ejemplo, la putrescina o butilendiamina y la cadaverina o pentilendiamina, provienen de la descarboxilación de la ornitina y lalisina, respectivamente, que son aminoácidos que se producen en la descomposición de proteínas animales.
Las aminas primarias que poseen de tres a once átomos de carbono son líquidas mientras que los homólogos superiores son sólidos. La dimetilamina es la única amina secundaria gaseosa y la trimetilamina es la única amina terciaria gaseosa. Cuanto mas grande sea el esqueleto de carbono de la amina, tanto menor es su solubilidad en agua. Las aminas secundarias y terciarias son menos solubles en agua que las primarias.
Las aminas aromáticas son líquidos de alto punto de ebullición o sólidos de bajo punto de fusión, menos menos solubles en agua que las aminas alifáticas.
Las sales de amonio cuaternarias son sólidos iónicos y, por tanto, sus propiedades son
diferentes de las aminas de donde provienen. Son inodoros, no volátiles, solubles en agua, pero insolubles en disolventes no polares
PROPIEDADES QUIMICAS DE LAS AMINAS
Basicidad
Las bases orgánicas más importantes son las aminas. La disponibilidad del par de
electrones no compartido del nitrógeno permite la captación de protones, según la reacción:
R - N H2 + H+ R - NH3
+
Las aminas alifáticas son bases mas fuertes que el amoníaco debido al efecto inductivo de los grupos alquílicos, ya que siendo estos donadores de electrones, tienden a incrementar la densidad electrónica en el átomo de nitrógeno haciendo mas asequible el par electrónico.
Las aminas terciarias, generalmente, son más básicas que el amoníaco pero menos básicas que las aminas primarias o secundarias comparables, ya que en ellas la disposición de los átomos es más importante que los efectos inductivos. El apiñamiento de los grupos voluminosos en torno al nitrógeno protege al par de electrones del ataque del protón.
Las aminas aromáticas en las cuales el nitrógeno se halla directamente unido al anillo
aromático son bases más débiles que las aminas alifáticas. Esto se atribuye a la
deslocalización del par de electrones por resonancia. El efecto neto de esta interacción por resonancia hace que disminuya la densidad electrónica sobre el nitrógeno. En consecuencia, el par solitario no es tan fácilmente asequible para formar un enlace con un ión hidrógeno como en el caso de las aminas alifáticas y el amoníaco en los que no existe tal interacción de tipo mesómero.
Los sustituyentes del anillo aromático poseen efectos predecibles sobre la basicidad de las aminas aromáticas. Los sustituyentes donadores de electrones incrementan la basicidad, en tanto que los atrayentes de electrones la hacen disminuir
Formación de sales
La propiedad más característica de las aminas es su capacidad para formar sales con los
ácidos. Estas sales son semejantes a las sales de amonio. Se forman en solución acuosa o haciendo pasar HCl, HBr, HI, etc., a través de una solución eterea de la amina. La sal es un sólido blanco insoluble en éter. La reacción general es:
R - NH2 + HX R - N H3.X + -
Reacción de nitrosación (HNO2)
El ácido nitroso reacciona en forma diferente con cada clase de amina, permitiendo
emplearse con ello su diferenciación. Con las aminas primarias el ácido nitroso reacciona formando un alcohol y liberando nitrógeno gaseoso, de la siguiente manera:
R - NH2 HNO2 R - OH N2 H2 O
KNO2
H Cl
+ + +
El ácido nitroso se encuentra en los numerosos agentes químicos que provocan mutaciones (alteración permanente de una molécula de DNA) ya que convierte los grupos aminos de las bases púricas y pirimidínicas en grupos hidroxilos.
Con las aminas secundarias, el ácido nitroso reacciona más lentamente que con las aminas primarias, formando compuestos que se conocen como “nitrosoaminas”. La reacción general es:
R - N - R' HNO2 R - N - N = O H2 O
R'
+ +
Nitrosoamina
Las nitrosoaminas son insolubles en el medio acuoso, y generalmente se separan como aceites amarillos. Los nitroso compuestos han demostrado ser carcinógenos potentes y, recientemente, se ha tomado consideración en el uso de nitritos y nitratos como conservadores de alimentos. Las bacterias estomacales reducen los nitratos a nitritos y estos, en presencia del ácido clorhídrico estomacal, se convierten en ácido nitroso. Así, el ácido nitroso reacciona con ciertas aminas secundarias corporales formando nitrosoaminas.
Con las aminas terciarias, el ácido nitroso reacciona formando sales de amonio cuaternario.
En casi todos los casos ocurre una reacción, pero como la sal es soluble en solución acuosa, no hay signo visible de reacción.
Alquilación de aminas
Las aminas presentan la propiedad de dejarse alquilar, reaccionando con halogenuros de alquilo y formando sales de amonio cuaternario que si se calientan se descomponen en la amina y el haluro de hidrógeno respectivo, de acuerdo a la reacción
R - NH2 + R' - X R - N H - R' + H - X
Reacción con hipocloritos alcalinos
Los hipocloritos alcalinos reaccionan con las aminas primarias y secundarias sustituyendo los átomos de hidrógeno unidos al nitrógeno por átomos de cloro. Las cloraminas resultantes tienen cierta utilidad como desinfectantes, ya que en solución acuosa se hidrolizan a la amina y el ácido hipocloroso. Un ejemplo de reacción de formación de cloramina es la siguiente:
R - NH2 + NaClO R - N H - Cl + NaO H
C loramina
Reacción de las aminas con iones metálicos
Las aminas, al igual que el amoníaco, pueden formar complejos con iones metálicos, coordinándose mediante el par de electrones solitarios, por ejemplo, con el Cu(II) forman un complejo debido a la tetravalencia del Cu(II) en el estado de hibridación dsp2
R - NH2 CuSO4
+ Cu (R - NH2)4- SO4
+2 -2
El color azul del sulfato cúprico pentahidratado se intensifica. Una reacción similar se plantea con el ión férrico, hexavalente de coordinación, por su hibridación d2sp3
Aminas importantes
Los neurotransmisores son las sustancias químicas que se liberan al transmitirse la señal eléctrica (impulso nervioso) entre dos células nerviosas (neuronas). No solo el mantenimiento de las funciones básicas de la vida (respiración, latir del corazón,
movimiento, etc.) depende de estas conexiones, sino también las funciones superiores,
como la inteligencia y la memoria. Los neurotransmisores mas extendidos fuera del Sistema Nervioso Central son la acetilcolina, la adrenalina y la noradrenalina. La acetilcolina es un condensado de ácido acético y el compuesto de amonio cuaternario llamado colina. La adrenalina y la noradrenalina son aminas aromáticas primaria y secundaria, respectivamente. Las neuronas que segregan el acetilcolina se conocen como colinérgicas, y las que segregan las dos últimas se llaman adrenérgicas. La adrenalina, la noradrenalina y la dopamina se llaman catecolaminas.
Otro transmisor es la amina de nombre histamina, un neurotransmisor que produce vasoconstricción del músculo liso bronquial, dilatación de los capilares y, además, estimula la secreción ácido del estómago
La amina serotonina está implicada en el control del sueño, ingestión de alimento, humor, sensibilidad dolorosa y liberación de hormonas hipofisiarias. Dado que la serotonina es un producto de la descarboxilación del aminoácido triptófano, la cantidad apropiada de este en la dieta permite una acumulación normal en el cerebro y un aumento puede ser importante en el tratamiento del insomnio o de la depresión.
La Enfermedad de Parkinson, caracterizada por rigidez muscular, temblor rítmico, lentitud de movimiento y rigidez del tronco, muestra una disminución de la amina dopamina y sus derivados, junto a las actividades enzimáticas de su síntesis. Para el tratamiento de la Enfermedad de Parkinson, se utiliza la amina L-dopa, que es un precursor de la dopamina hidroxianfetamina. Las anfetaminasimulan el Sistema Nervioso Central y frecuentemente reciben el nombre de simpaticomimeticas, ya que imitan la acción de la adrenalina y la noradrenalina en dicho Sistema. Algunas son, la anfetamina (βfenilisopropilamina), metanfetamina, efedrina, fenilefrina e causan liberación de dopamina, pueden producir psicosis como la esquizofrenia en sujetos normales y pueden exacerbar los síntomas en sujetos esquizofrénicos
Las ptomainas son aminas tóxicas producidas durante la putrefacción de proteínas
alimenticias al descarboxilarse los aminoácidos. Ejemplos de ptomainas son la cadaverina, la putrescina, la agmalina (derivada de la arginina), la histamina (derivada de la histidina), la triptamina (derivada del triptófano) y la tiramina (derivada de la tirosina9.Las aminas anfetaminas pertenecen a un grupo de drogas sintéticas que estan. La tiramina es una amina dietética contenida en el queso, chocolate, mermelada y vino tinto que si no son oxidados entran en la circulación general y causan la liberación de adrenalina y noradrenalina. Esto produce una vasoconstricción periférica y aumento del gasto cardíaco, lo que causa una hipertensión grave y puede provocar dolor de cabeza, palpitaciones, hemorragia subdural, apoplejía o infarto de miocardio.
http://www.antoniobatista.es/Documentos/2º
%20BCH/APUNTES%20FORMULACIÓN%20ORGÁNICA.pdfhttp://www.galeon.com/scienceducation/organica.html
http://galeon.hispavista.com/melaniocoronado/AMINAS.pdf
http://www.alonsoformula.com/organica/aminas.htm
http://www.itescam.edu.mx/principal/sylabus/fpdb/recursos/r53778.PDF
http://www.quimicaorganica.net/aldehidos-cetonas.html
http://www.oocities.org/pelabzen/enol.html
http://organica1.org/qo1/Mo-cap7.htm
http://rabfis15.uco.es/weiqo/Tutorial_weiqo/Hoja14a1a2P1.html
http://organica1.org/qo1/MO-CAP3.htm
http://www.sinorg.uji.es/Docencia/QO/tema1QO.pdf
http://www.quimicaorganica.net/alcanos.html
http://www.uam.es/departamentos/ciencias/qorg/docencia_red/qo/l1/const.html
http://organica1.org/qo1/MO-CAP1.htm
QUMICA/ BROWN
Quimica Organica (compuestos organicos)